La vacuna rusa será probada en 2.000 personas en el país. Hasta ahora, se sabe poco de la metodología, solo que las pruebas iniciarán en Caracas.
La viróloga Flor Pujol explica en detalle las etapas y las condiciones que debe cumplir el ensayo en fase III para que la vacuna sea considerada eficaz y segura
El pasado viernes, 2 de octubre, el régimen de Nicolás Maduro anunció con bombos y platillos la llegada de 2.000 dosis de la vacuna contra COVID-19 Sputnik V, fabricada en Rusia por el Instituto Gamaleya.
Esta vacuna figura en la lista de las 10 que la Organización Mundial de la Salud registra en fase III de investigación, la etapa crucial para definir la efectividad de un fármaco.

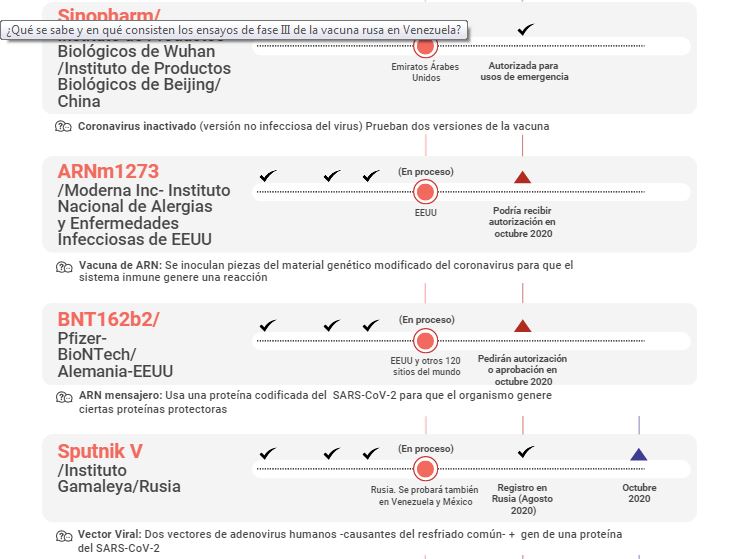


La vacuna rusa contra COVID-19 consta de dos componentes: un vector de adenovirus recombinante tipo 26 y otro vector de adenovirus recombinante tipo (5). Ambos portan un gen del coronavirus pandémico descubierto a finales de 2019 en Wuhan, China.
Los adenovirus son un grupo de virus que causan típicamente infecciones en el tracto respiratorio e intestinal. Son utilizados como base potencial para el desarrollo de vacunas desde el año 1953. Se consideran como vectores excelentes, porque tienen una amplia capacidad de inducir la respuesta del sistema inmune natural y adaptante.
Los fragmentos de adenovirus de este candidato vacunal fueron atenuados o debilitados para que no se repliquen en el organismo de la persona sana. Contienen el gen de una proteína del nuevo coronavirus (SARS-CoV-). La intención es estimular la respuesta inmune del individuo sano y la vacuna sería aplicada en dos dosis: la segunda sería administrada tres semanas después de la primera.
¿Qué se sabe hasta ahora sobre los ensayos de la vacuna rusa en Venezuela?
- La organización Médicos Unidos por Venezuela alertó en un comunicado que la vacuna desarrollada por Rusia no es confiable aún por seguir en fase de desarrollo y denunció que no se ha comunicado a las sociedades científicas, ni a la población, sobre la metodología o protocolo que se usará en el país para los ensayos. Advirtieron que, hasta que no se compruebe su eficacia en fase III, la vacuna no puede ser usada masivamente en humanos.
- El infectólogo Julio Castro aclaró que la llegada de la vacuna solo implica la realización de un estudio y que no es la solución para modificar el curso de la epidemia en Venezuela, por lo que instó a mantener las medidas preventivas conocidas (distancia física, lavado constante y adecuado de manos y uso del tapabocas). Recordó además que los estudios en fase III pueden tardar meses y que, para que se compruebe la eficacia y seguridad de la vacuna, los resultados deben estar disponibles y ser revisados por pares.
- El Ministerio de Ciencia y Tecnología anunció el 2 de octubre que ya habían sido seleccionados los especialistas que liderarán el proyecto de fase III en Venezuela, así como los centros de investigación para el respectivo acompañamiento del proceso. No revelaron inicialmente quiénes son los expertos, ni cuáles los centros.
- El ministro de Salud del madurismo, Carlos Alvarado, anunció el 6 de octubre que los 2.000 voluntarios serían escogidos a través de una encuesta en un sitio web y previa evaluación física. Recalcó que “tienen que ser personas sanas” y sin tatuajes en el brazo, puesto que la pigmentación causa reacciones al contacto con la vacuna.
¿Cómo es el proceso del ensayo de vacuna en fase III?
En entrevista con Unión Radio, la virólogo venezolana Flor Pujol, presidenta de la Asociación de Investigadores del Instituto Venezolano de Investigaciones Científicas (IVIC), explicó de forma detallada cuál es el procedimiento que se sigue tradicionalmente durante un ensayo en Fase III y que debería ser aplicado en Venezuela durante las pruebas de la vacuna rusa.
Indagó también en las condiciones bioéticas que deben cumplir estos ensayos para garantizar la seguridad y eficacia de la vacuna.
- La fase III es la prueba de fuego que mide la eficacia de la vacuna: esto es si protegerá o no contra la infección. Incluye una mayor cantidad de voluntarios que en la fase I (inocuidad, que evalúa efectos adversos) y en la fase II (Inmunogenicidad, en la que se mide si la candidata produjo anticuerpos contra el virus).
- En la fase III, un grupo control recibe la vacuna y otro recibe un placebo (sustancia que no actúa contra la enfermedad, por lo general, una solución salina).
- Estos estudios deben ser doble ciego y transparentes: Ni el voluntario debe saber qué le aplicaron, ni quien aplica la vacuna tampoco debe saber que está aplicando: “Un comité tiene los códigos, para que no haya sesgo en el análisis y en la administración. Siempre debe haber un grupo control que no la recibe y uno que sí”, explica Pujol.
- Después de transcurrido un tiempo, se evalúa si en ese grupo de personas hay casos de contagios o infecciones. Es el momento en el que el comité “abre los códigos” y determina cuánta gente se infectó entre los vacunados y cuántos entre los que recibieron placebo: “Si hay un menor número de personas contagiadas entre los vacunados, decimos que la vacuna tiene eficacia, si ninguno se infectó, decimos que la vacuna tiene 100% de eficacia, lo cual ocurre en muy pocas ocasiones. Una vacuna excelente tiene 95% de eficacia, como la de sarampión o hepatitis”, recalcó Pujol.
- El nivel de eficacia debe estar por encima del 50% para que se considere que la vacuna es eficaz, pero también hay otra forma para llegar a esa conclusión, explica la experta: “Una es el número de personas que se infectan y la otra, que quizá suena menos interesante, o es menos ambiciosa, es que aunque las personas se enfermen, cursen la infección más leve, lo que ocurre con la vacuna de rotavirus, que evita la diarrea sea menos grave y no haya deshidratación”, abundó la virólogo.
- En la fase III se deben seguir monitoreando los efectos adversos. Hace unas semanas, el ensayo en fase III de la vacuna de Oxford se pausó unos días porque uno de los participantes presentó un caso de mielitis transversa. “En la prueba en fase I no salió a flote, porque era en un número reducido de participantes. En la fase III, que involucra a miles de personas, se debe evaluar el tema de las reacciones. Si ese efecto adverso se presenta en cada 1.000 personas, por ejemplo, es un dato importante que llevaría a considerar, dependiendo o no de su gravedad, la suspensión de la vacuna”.
- Otro aspecto fundamental en la transparencia en los datos y en el análisis de la información: “Estas fases están siendo publicadas en revistas validadas por pares y la comunidad científica está muy pendiente”. Debe haber, entonces, un escrutinio independiente de los resultados por parte de las sociedades médicas y científicas, para lo cual es fundamental que los datos del ensayo sean abiertamente compartidos.
Al respecto de este último punto, Pujol recordó que hubo una primera publicación, el pasado 4 de septiembre y en la prestigiosa revista The Lancet, sobre los resultados de la aplicación de la vacuna rusa en fase I y II.
“Esa publicación no ha sido retirada y recibió comentarios de algunos científicos, quienes denunciaron que algunos controles parecían repeticiones y que había algunos aspectos del artículo que no lucían muy convincentes. Eso, obviamente, genera inquietud y preguntas. El 26 de septiembre salió un nuevo artículo sobre la fase I y II combinada en The Lancet. De alguna forma, están los datos, donde se muestra que en un pequeño número de participantes (76) no se registraron efectos adversos de importancia y que todas las personas inmunizadas generaron anticuerpos contra el coronavirus”, amplió.
La científica consideró fundamental insistir en el mensaje de que la llegada de un prototipo de vacuna no significa que estamos “salvados” y que se debe descuidar la protección contra el COVID-19.
“Debemos seguir manteniendo la prevención, ni siquiera los voluntarios que reciban la prueba pueden pensar que están protegidos, porque pueden haber sido inmunizados con el placebo, o puede que la vacuna no funcione”, concluyó Pujol.
Lea más en www.runrun.es